山东第一医科大学生命科学学院杨明教授、化学与制药工程学院孙晓教授课题组展开联合攻关,提出了一种联合铁蛋白诱导与CRISPR/Cas9系统协同抑制光热治疗抵抗的创新策略。相关成果以“Overcoming Photothermal Resistance of Gastric Cancer by Bionic 2D Iron-Based Nanoplatforms with Precise CRISPR/Cas9 Delivery”为题,2025年5月8日发表于《ACS Nano》杂志,论文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c16846。
光热治疗因其能够在精准杀伤肿瘤细胞的同时尽量减少对正常组织的损伤,成为近年来备受关注的抗癌策略。然而,肿瘤细胞可通过上调热休克蛋白(HSPs)的表达来激活内源性防御机制,从而抵抗热应激带来的损伤,显著削弱光热治疗的治疗效果,成为限制其临床应用的主要障碍。因此,研发能够靶向抑制HSPs功能或降低其表达的新策略,成为提高光热治疗疗效的关键。
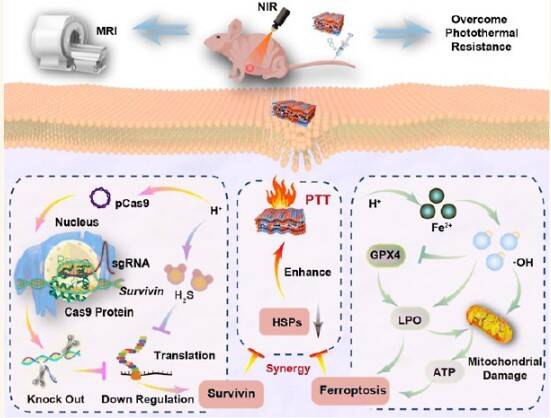
基因治疗为肿瘤精准治疗提供了新思路,其中CRISPR/Cas9基因编辑系统凭借其高效可靶向特性,已成为癌症治疗研究的热点工具。在基因递送载体方面,具有良好生物相容性与可降解性的二维纳米材料正在被广泛关注。基于此,山东第一医科大学杨明教授、孙晓教授课题组展开联合攻关,构建了一种由二维硫化亚铁(2D FeS)纳米片组成、表面修饰红细胞-肿瘤细胞仿生膜并负载CRISPR/Cas9的复合纳米片(FCRM)。该系统融合了光热治疗、基因表达调控和靶向递送等多重功能,具有良好的生物稳定性和长循环特性。在近红外激光照射下,该材料产生热量,同时在肿瘤微环境中释放Fe²+,诱导脂质过氧化和凋亡反应。CRISPR/Cas9系统则在局部肿瘤区域高效释放并下调胃癌细胞中Survivin基因表达,通过铁蛋白富集与Survivin抑制的协同作用降低HSPs水平,显著增强了光热治疗的治疗效果。此外,FCRM还可引起显著的肿瘤磁共振造影增强,有助于肿瘤的准确诊断。
山东第一医科大学杨明教授、孙晓教授为本文通讯作者,博士后刘慧、博士后杨延婷和附属肿瘤医院张娜莎副研究员为本文共同第一作者。本研究得到国家自然科学基金、山东省重大创新工程、山东省自然科学基金、山东省泰山学者项目、山东省卫生健康科创团队、山东第一医科大学(山东省医学科学院)新兴战略领域研究培育计划项目支持。
拍摄: 杨明
责编: 殷晓蕾
终审: 尹刚
 >>首页
>>正文
>>首页
>>正文

 >>首页
>>正文
>>首页
>>正文
