近日,山东第一医科大学生命科学学院王昌龙教授团队在《Advanced Materials》杂志(IF=27.4)上发表题为“Dismountable Protein Corona-Modified Virus-Like Manganese-Arsenic Nanomedicine Enables Safe and Targeted Delivery for Synergistic Arsenotherapy”的研究论文。课题组博士后田海娜为本论文第一作者,王昌龙教授,邵凤英副教授和李照伟副教授为本论文通讯作者,山东第一医科大学生命科学学院为第一完成单位。 
砷剂是一种历史悠久的药方组分,其中三氧化二砷已被FDA批准用于临床治疗急性早幼粒细胞白血病(APL),显示出提高APL患者生存率的巨大潜力。然而,这种砷剂治疗由于肾脏清除率快,靶向能力低,递送效果差,治疗效果不佳,尚未成功用于实体肿瘤治疗。病毒具有高效入侵细胞的特点,因此模拟病毒的结构特点可以有效提高细胞对药物的内吞。但是,病毒样颗粒与生物分子或细胞之间的强相互作用不具有特异性,不仅诱导蛋白质粘附在纳米颗粒上形成蛋白冠影响细胞摄取效率,而且在血液循环过程中对正常组织带来潜在的危害。
鉴于此,山东第一医科大学王昌龙教授课题组创新性地发展了一种可拆卸高密度脂蛋白(HDL)修饰的病毒样锰砷药物制剂,以实现安全靶向递送和协同砷治疗。利用HDL形成的蛋白冠对病毒样锰砷颗粒的尖状表面进行动态屏蔽,可以避免吸收其他无用蛋白,并利用HDL与其受体SR-B1之间的相互作用,提高肿瘤靶向递送。在肿瘤酸性微环境中,pH响应的HDL蛋白冠从病毒样颗粒表面解离并与巨噬细胞相互作用,促进M2型巨噬细胞向M1型极化。重新暴露的病毒样颗粒被肿瘤细胞有效内吞并诱导细胞凋亡,同时释放双链DNA(dsDNA)和锰离子,共同激活树突状细胞(DCs)中cGAS-STING信号通路。M1型巨噬细胞的极化和DCs的激活共同逆转了免疫抑制微环境,引发了有效的抗肿瘤免疫治疗。本工作为砷靶向递送和疾病高效诊疗提供了新的策略。
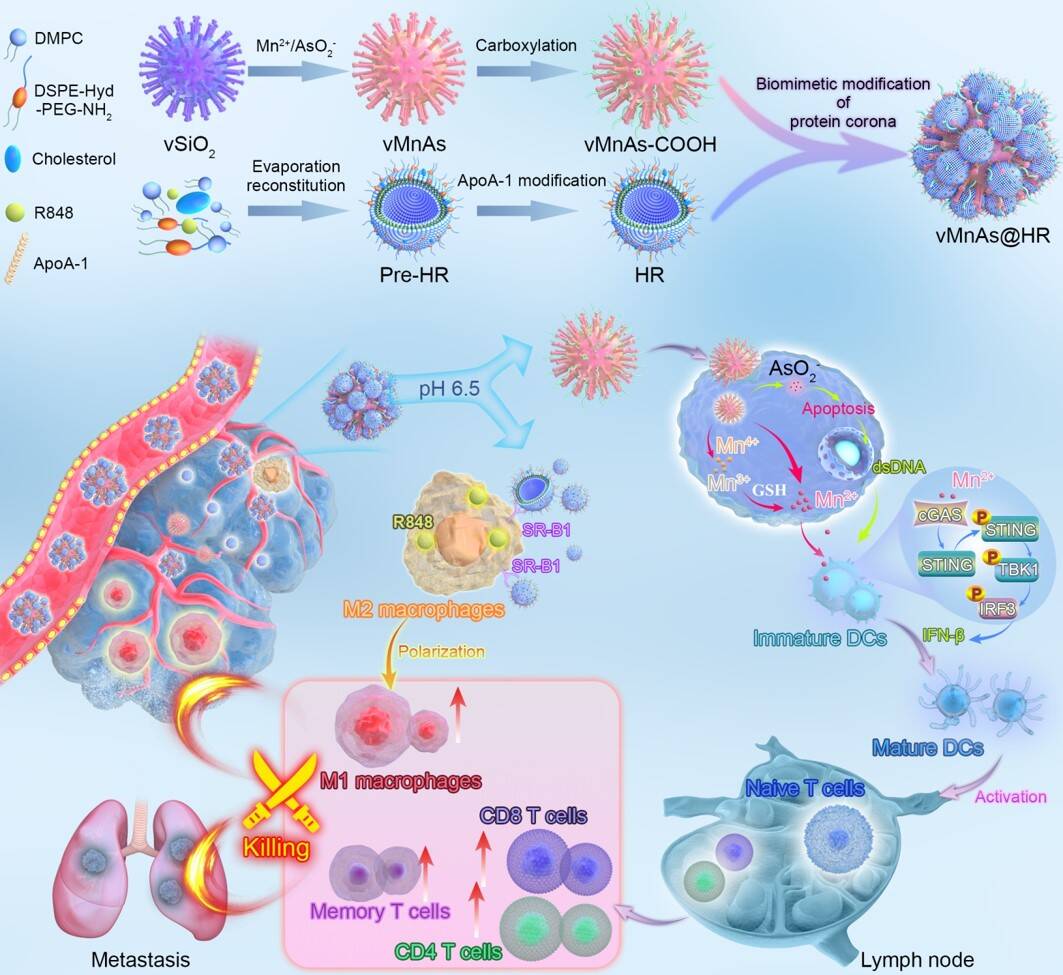
课题组成立以来一直聚焦于基于内源性载体的仿生递送,用于疾病的高效诊疗。本工作是在前期研究基础上的又一重要进展(Nature Nanotechnology 2021, 16, 1413; Advanced Materials 2022, 2107150; Biomaterials 2023, 301, 122284; Biomaterials 2021, 274, 120869; ACS Applied Materials & Interfaces 2024,4c06034),发展了高密度脂蛋白的表面仿生修饰策略,实现了化疗药物砷对于实体肿瘤的协同治疗。
该项工作得到了国家自然科学基金、山东省自然科学基金、山东省泰山学者、山东省高校青年创新团队项目、山东省医药卫生科技项目的支持。
https://onlinelibrary.wiley.com/doi/10.1002/adma.202408361
 >>首页
>>正文
>>首页
>>正文

 >>首页
>>正文
>>首页
>>正文
